杨维才研究组揭示受体蛋白激酶的内质网分选机制
内质网是细胞内负责分泌蛋白合成、折叠和分选的细胞器。不同的分泌蛋白在正确折叠后被分选和运输到高尔基体或液泡等不同下游细胞器,进行进一步修饰、分选等过程。蛋白的分选是维持细胞稳定的基本机制之一,这一机制保证了正确折叠的蛋白在正确的时间被运输到正确的位置。蛋白的分选发生异常,会导致细胞的稳态出现紊乱。新生的蛋白在内质网腔内,被分子伴侣识别和帮助折叠,而定位在内质网胞质面的蛋白分选机器负责分选囊泡的形成和运输。在这个过程中有两个未解的科学问题:第一、正确折叠的蛋白的信息如何传递给分选机器?第二、不同的分泌蛋白的特异性分选机制是什么?
分子发育生物学国家重点实验室杨维才研究组前期在拟南芥中发现了一个定位于内质网的蛋白POD1与内质网分子伴侣CRT3互作,调控花粉管对胚囊信号的响应(Li et al. 2011, Plant Cell)。最新的研究发现,POD1-CRT3与三个内质网膜蛋白SUN3/4/5形成蛋白复合体。进一步发现sun3/4/5突变体植株根系变短、株高降低,花粉管的生长和导向缺陷导致角果败育,与pod1的表型类似。CRT3之前被报道负责将错误折叠的受体蛋白激酶bri1-5和bir1-9滞留在内质网内,因此研究者观察了BRI1-GFP在sun3/4/5中的定位,相较于其在野生型中的质膜定位,sun3/4/5中BRI1-GFP定位于酸性囊泡。将bri1-5和bri1-9引入sun3/4/5后,加重bri1-5, bri1-9表型,说明BRI1的正确定位依赖于SUNs。
BRI1属于LRR-RLK家族蛋白,那么SUNs是否也调控其它LRR-RLK蛋白的分选呢?在植物生殖过程中LRR-RLK家族蛋白在花粉管的生长及导向过程中发挥重要作用,如PRK2、PRK3、MDIS1等。在sun3/4/5花粉管中,这些受体蛋白激酶也都定位于酸性囊泡中,药物处理显示这些酸性囊泡形成依赖于prevacuolar compartment(PVC)途径。为了进一步证明SUNs对于LRR-RLK分选的调控机制,将PRK2-GFP的LRR结构域去掉,在野生型和sun3/4/5花粉管中,蛋白都被分选到酸性囊泡。将PRK2-GFP的胞外域去掉,只保留信号肽和跨膜域前20个氨基酸,在野生型和sun3/4/5花粉管中,蛋白都定位于质膜。将PRK2的胞外域连接到跨膜蛋白Lit6b的N端,GFP-PRK2ECD-Lti6b在野生型花粉管中定位于细胞膜,而在sun3/4/5花粉管中定位于酸性囊泡,表明LRR结构域决定了LRR-RLK的SUN介导的分选过程。综上,这一研究揭示了一个调控受体蛋白激酶的内质网分选的分子机制。
该项研究成果以题为“POD1-SUN-CRT3 Chaperone Complex Guards the ER Sorting of LRR Receptor Kinases in Arabidopsis”于2022年5月16日在线发表在Nature Communications(DOI:10.1038/s41467-022-30179-w)。杨维才研究组已毕业的薛勇博士和孟姜果博士为该论文的共同第一作者,贾鹏飞博士和张峥嵘参与了部分工作,杨维才院士和李红菊研究员为共同通讯作者。该项目受到国家自然科学基金的资助。
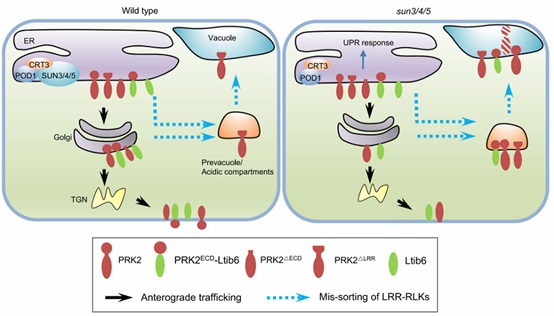
图:POD1-SUN-CRT3复合体调控受体蛋白激酶分选的分子机制模型
附件下载: