许执恒研究组合作揭示孤独症发病的新分子机制
孤独症谱系障碍(Autism Spectrum Disorder,ASD)是一类复杂的遗传异质性神经发育疾病。Shanks基因家族是ASD高风险致病基因。迄今发现的ASD易感基因大多与突触功能调控相关。N-甲基-D-天冬氨酸(N-methyl-D-aspartate;NMDA)受体是一类突触后离子型谷氨酸受体,介导并调控突触可塑性。Shank2/3基因缺失/突变的小鼠ASD模型表现出不同程度的NMDA受体功能障碍,调控NMDA受体功能可以有效改善ASD模型中孤独症样表型。然而,Shank 介导的 NMDAR 功能调节所涉及的分子机制仍不清楚。
2022年4月5日,分子发育生物学国家重点实验室和北京师范大学的团队合作在Cell Reports发表了一篇题为“POSH Regulates Assembly of the NMDAR/PSD-95/Shank Complex and Synaptic Function”的论文成果。该项研究利用条件敲除型小鼠,结合生物化学、小鼠行为学分析和神经电生理等技术阐明了JNK信号通路支架蛋白POSH与突触后支架蛋白PSD-95和SHANK2/3共同聚集在突触后调控突触形态发生。POSH缺失导致POSH cKO小鼠海马脑区中NMDA受体各亚基和SHANK2/3在突触后的分布显著减少,NMDAR的突触后电流和NMDAR依赖的LTP显著缺陷,进而影响突触的发育及可塑性,造成POSH缺失小鼠典型的孤独症样行为和学习记忆能力障碍。
本研究不仅证实了POSH是潜在的ASD相关基因,而且证明POSH与PSD-95和SHANK2/3互作,在NMDAR介导的生理活性、突触发育、个体行为,以及学习和记忆中发挥重要作用,进一步促进了对ASD发病机制的认识,为今后ASD相关研究和治疗提供了有价值的动物模型。
分子发育生物学国家重点实验室许执恒研究员和北京师范大学章晓辉教授为该论文的共同通讯作者。许执恒研究组助理研究员姚明慧为该论文的第一作者及共同通讯作者。该研究得到国家基金委、科技部及中科院项目的资助。
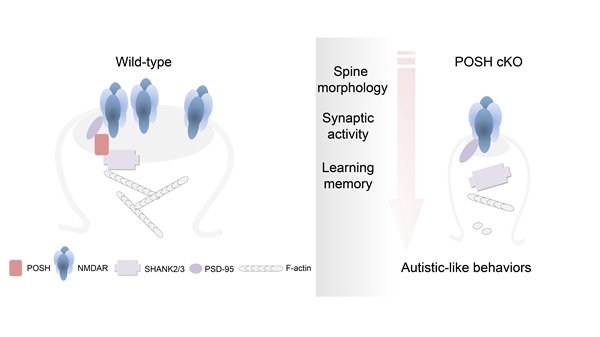
图: POSH与PSD-95和SHANK2/3互作,在NMDAR介导的生理活性、突触发育以及个体行为中发挥关键作用
附件下载: