陈宇航研究组解析新型阴离子通道QUAC1/ALMT12的结构与工作机制
植物体内阴离子的跨膜转运参与细胞信号转导和膨压调控,在生长发育和逆境响应等方面发挥重要作用。ALMT家族蛋白是植物所特有的一类新型阴离子通道,参与调控气孔运动、果实酸度、种子发育、根系抗铝毒等生物学过程(图A)。其中,ALMT12参与控制气孔关闭,其具快型 (R-type)阴离子通道特征,故又名快阴离子通道QUAC1。
护卫细胞阴离子外流是启动气孔关闭的关键事件,主要受慢阴离子通道SLAC1和快阴离子通道QUAC1/ALMT12调控。分子发育生物学国家重点实验室陈宇航研究组继解析了首个慢阴离子通道SLAC1三维结构后(DOI:10.1073/pnas.2015151118),在调控气孔关键离子通道研究方面又取得突破。研究者利用单颗粒冷冻电镜技术首次解析了大豆来源的QUAC1/ALMT12的3.5埃分辨率三维结构。该结构揭示QUAC1/ALMT12形成一个同源二聚体,其整体分子形如一个“花瓶”,中间形成一个奇特的T型跨膜孔道(图B)。该离子通道形成由跨膜结构域(TMD)和胞质结构域(CHD)的双层构造。由于两个单体的C端在胞内互作在一起,使得离子通道的双层构造处在一种扭曲的“高能量”状态,这可能是其作为快阴离子通道的结构基础。进一步电生理研究发现该离子通道可被苹果酸盐激活,介导阴离子外流。该离子通道介导的电流具有电压依赖的特征,并表现了快速激活/去激活的动力学特性。进一步突变研究揭示了离子通道C端二聚体互作对活性的关键调控作用。综合来自结构研究,电生理学分析以及Alphafold2模拟等结果,研究者提出了该类新型阴通道的新颖的门控机制(图C)。
该研究成果于2022年3月2日以标题为“Cryo-EM structure and electrophysiological characterization of ALMT from Glycine max reveal a previously uncharacterized class of anion channels”在线发表于Science Advances杂志(DOI:10.1126/sciadv.abm3238)。陈宇航研究组博士后秦力,博士生唐凌汇、张显慧,以及中国科学院生物物理研究所孙飞研究组博士生徐嘉树、副研究员朱赟为该论文的共同第一作者。陈宇航研究员及其组内苏敏高级工程师、孙飞研究组翟宇佳副研究员为该论文的共同通讯作者。该研究还得到了纽约大学李飞教授的帮助。该研究受科技部、国家自然科学基金委和中科院战略先导专项的资助。
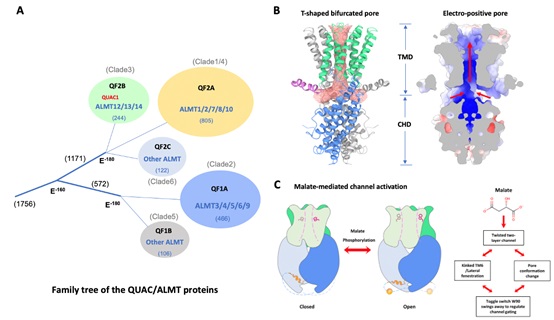
图:新型阴离子通道QUAC1/ALMT12的三维结构与工作机制
A. QUAC/ALMT蛋白超家族进化树;B. QUAC1/ALMT12三维结构揭示了一类新型的
阴离子通道,具有奇特的T形孔道;C.苹果酸盐介导离子通道的激活机制。
附件下载: